
beat365中国唯一官网曾凯芳教授团队与香港理工大学食品科学及营养学系陈声教授团队的合作研究于2026年1月23日以《Novel Antimicrobial Nano Bacteriocin: Lactic Acid Bacteria-Derived, Self-Assembled, and Enhanced for Superior Antimicrobial Activity》为题在线发表于《Advanced Materials》(IF=26.8)。西南大学易兰花副教授、香港理工大学李晟阳博士和谢苗苗博士后为论文共同第一作者。
本研究从中国传统发酵食品泡菜中分离得到一个植物乳杆菌来源的新型细菌素,并通过疏水性改造,使其无需外加刺激或载体,即可在培养基甚至NaCl溶液中自发组装为纳米颗粒。该纳米细菌素同时对革兰氏阳性和阴性菌表现出高效抗菌活性,展示了乳酸菌来源纳米抗菌剂在安全、可持续抗菌应用中的巨大潜力。本研究不仅突破了传统抗菌肽稳定性和抗菌谱受限的瓶颈,也为未来在食品防腐、耐药菌控制及替代抗生素方面的应用提供了重要思路与理论基础。
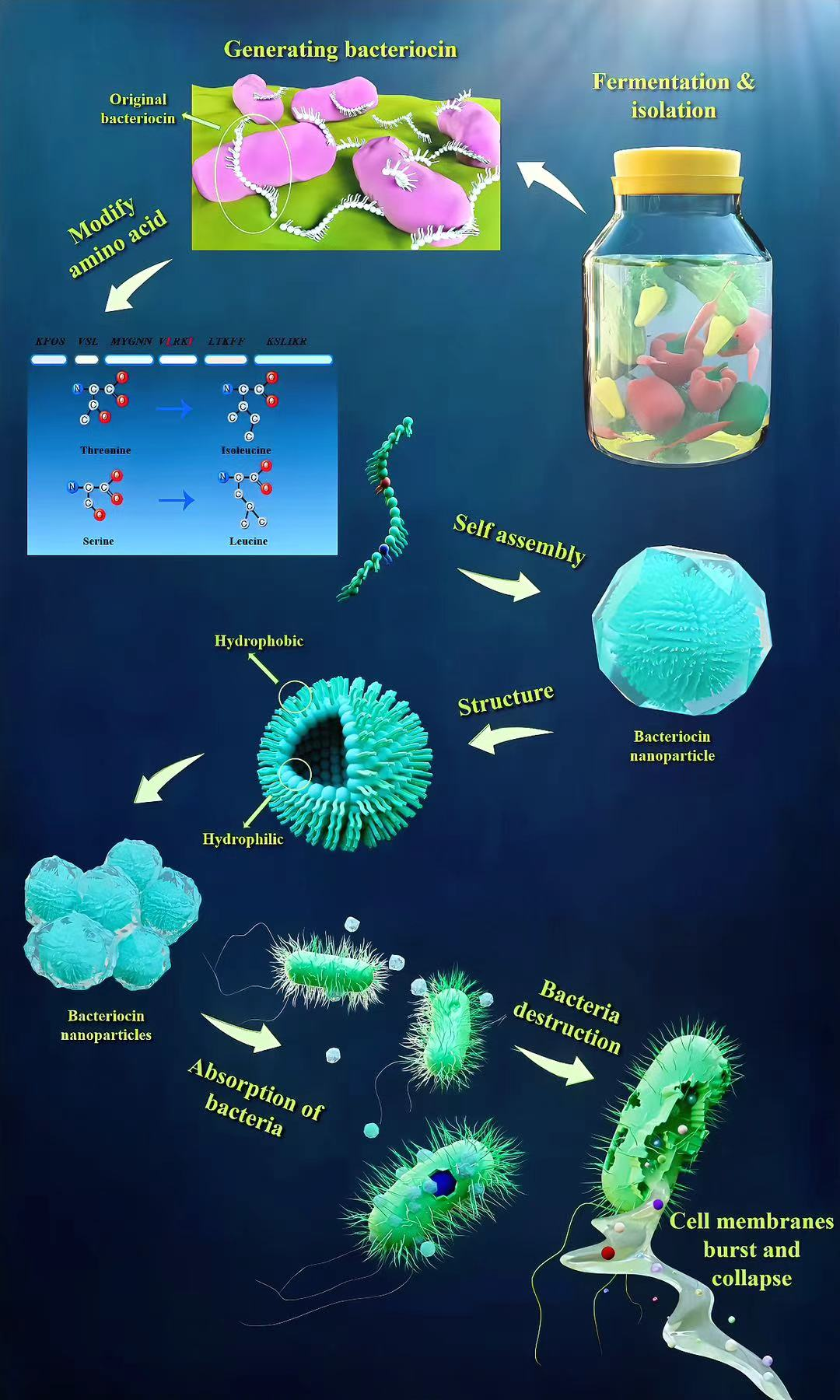
图1概要示意图。该示意图展示了源自发酵食品泡菜中乳酸菌(LAB)的细菌素的整体概况,涵盖多个关键方面,包括细菌素的生成、修饰、结构、自组装成纳米颗粒的过程,以及细菌素纳米颗粒的抗菌机制。
研究结果1:从天然细菌素到纳米颗粒
研究团队从36种传统发酵食品(如泡菜、豆腐乳)中分离出183株乳酸菌,最终锁定多株产抗菌活性物质的植物乳杆菌。通过全基因组测序与生物信息学分析,研究者鉴定出多种全新的细菌素分子,并筛选出一种抗菌活性最优的候选细菌素(KFQS-28)。通过理性氨基酸替换:将丝氨酸改为亮氨酸、苏氨酸改为异亮氨酸,提高其疏水性,获得了改良型细菌素KFQS28-m2。
关键发现:这种改造后的细菌素无需任何载体,在常见培养基(如TSB、LB、MH)中即可自发组装成纳米级抗菌颗粒,即便在简单的NaCl溶液中也能发生自组装,将其命名为纳米抗菌细菌素(NAMBs)。实验和分子动力学模拟共同证实,培养基中的NaCl和蛋白胨可通过屏蔽电荷排斥、增强疏水作用和氢键网络,显著促进细菌素的自组装过程,使其形成尺寸均一、结构稳定的纳米颗粒。
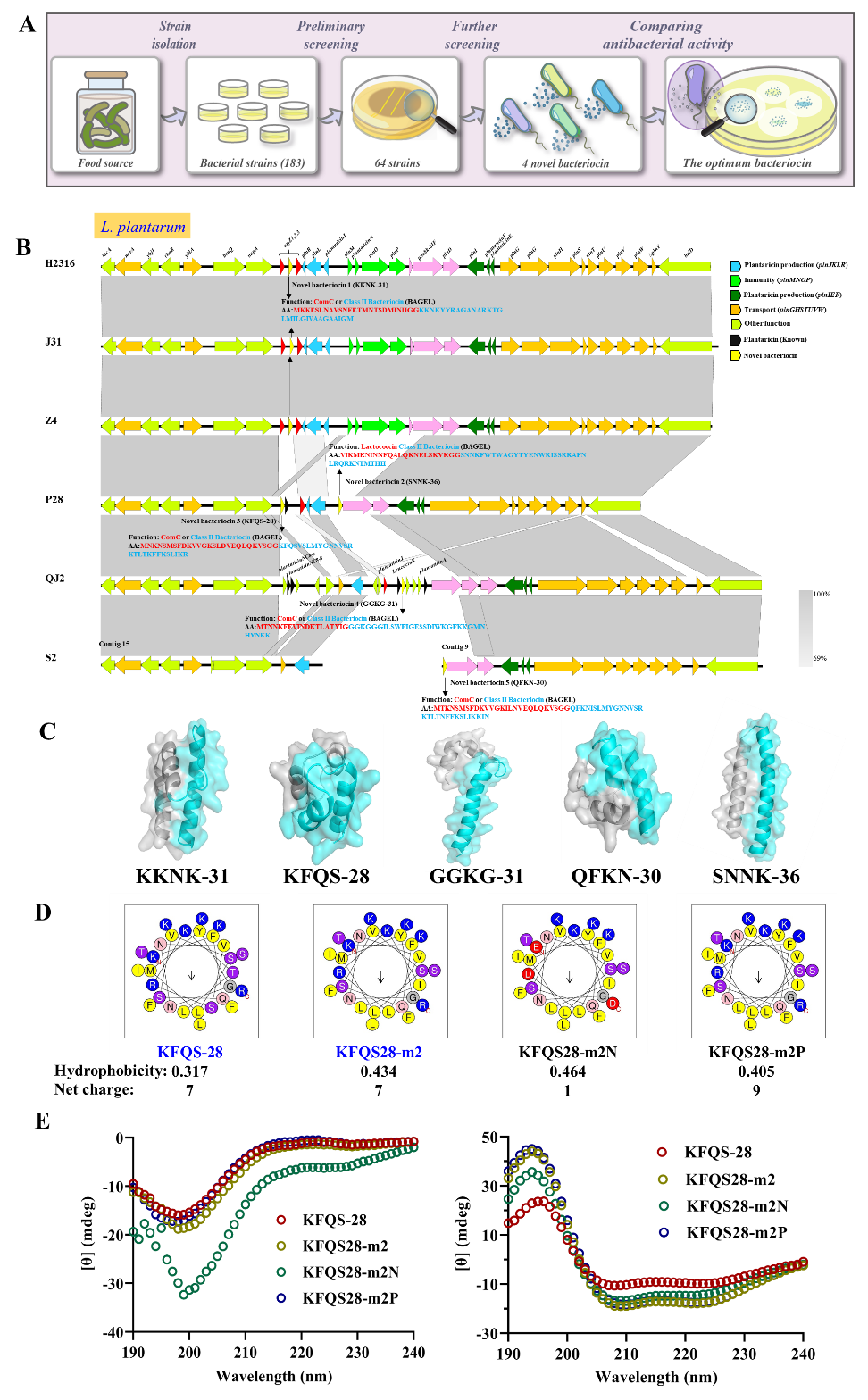
图2新型抗菌细菌素的发现
分子动力学模拟显示,氯化钠(NaCl)在自组装中扮演重要角色:它能屏蔽肽链间的静电排斥,加速疏水作用驱动的聚集。在0.1M NaCl溶液中,150条细菌素肽链在350纳秒内形成20个大型簇群,而纯水中仅形成29个松散小簇。氢键网络分析进一步揭示,NaCl环境下的肽链C端和N端更易形成分子间氢键,如同搭扣般锁定纳米结构。
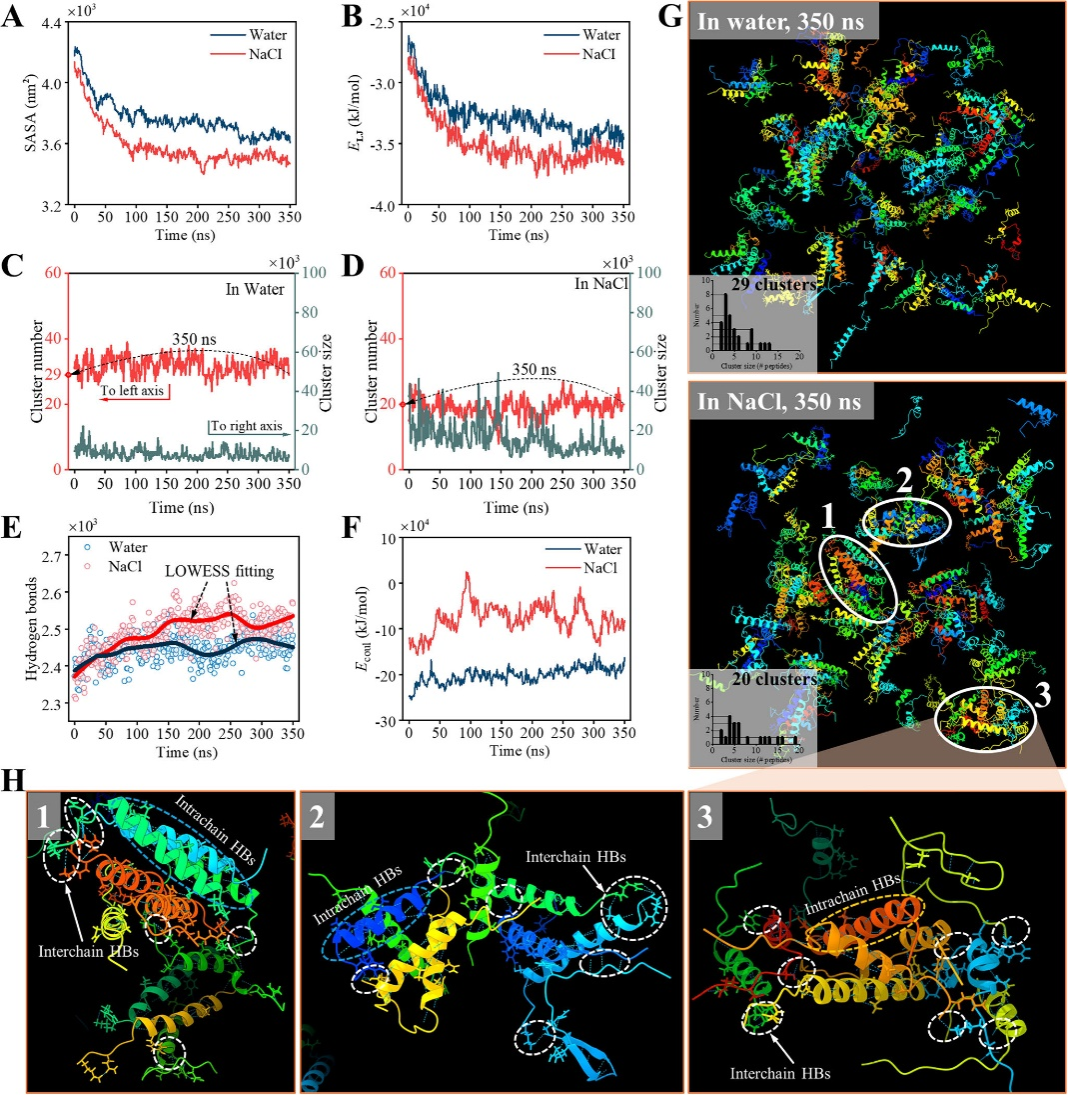
图3水溶液与氯化钠溶液中0-350纳秒分子动力学模拟的肽聚集动力学、热力学及结构分析。
研究结果2:细菌素纳米颗粒的可控自组装
实际实验中,只需将修饰后的KFQS-28-m2加入TSB、LB或MH培养基,5分钟内即可形成粒径293-381纳米的颗粒。有趣的是,可以通过调控环境体系(pH、离子强度、极性等)灵活地改变纳米颗粒的形貌和大小,这为可控自组装提供了方向。
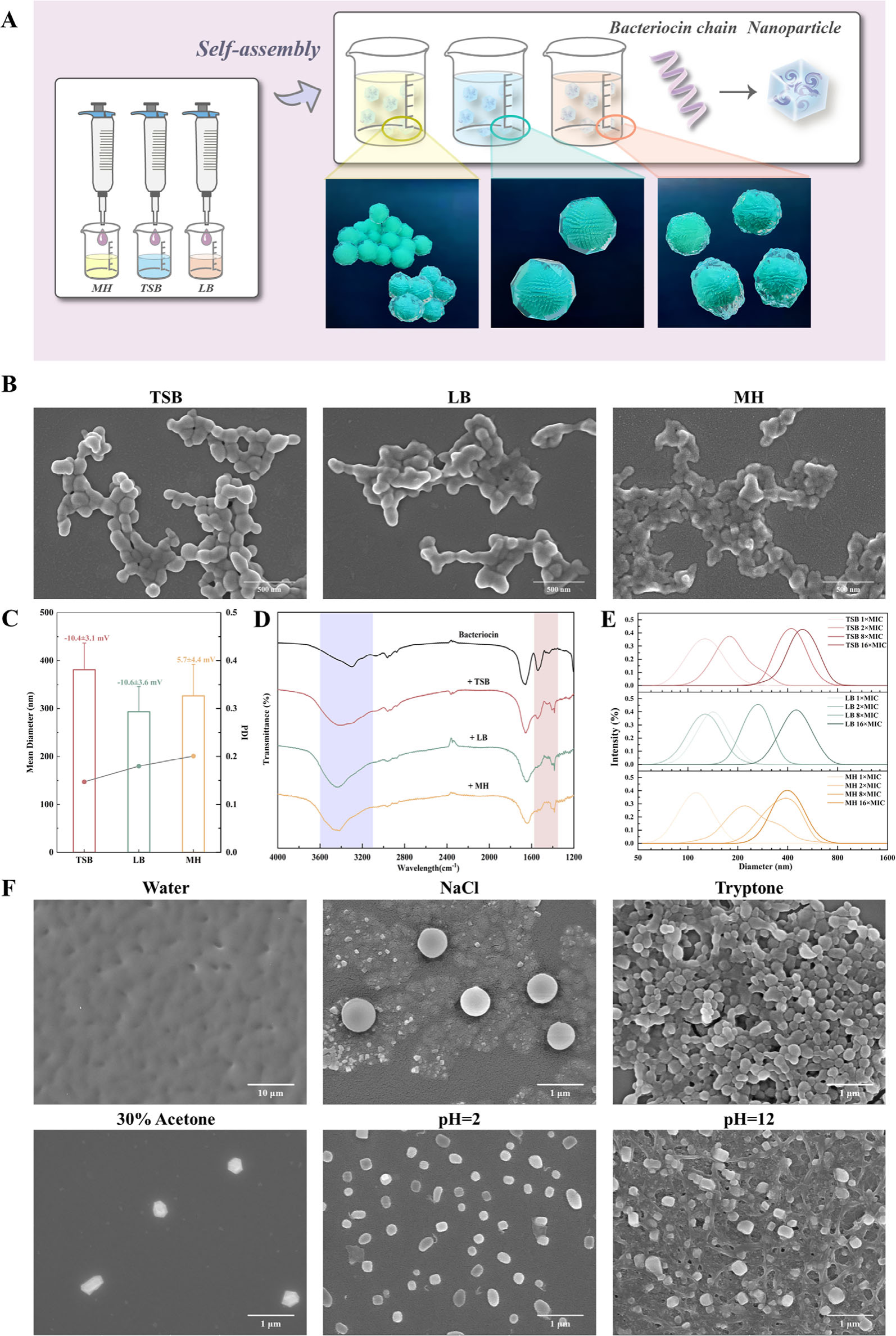
图4新型抗菌细菌素自组装形成纳米颗粒。
研究结果3:细菌素纳米颗粒具有强抑菌活性
在体外实验中,NAMBs具有广谱抑菌活性,包括抑制单核细胞增生李斯特菌(革兰氏阳性)、鲍曼不动杆菌和副溶血弧菌(革兰氏阴性)。离心分离实验证明抗菌活性完全来自纳米颗粒本身——沉淀物(自组装的纳米颗粒),而上清液(残留的未组装分子)几乎无效。
小鼠感染模型进一步验证了其体内疗效:在大腿感染模型中,0.25 μmol/kg NAMBs使鲍曼不动杆菌载量下降99%(p=0.0034);在腹膜炎模型中,1 μmol/kg NAMBs将感染小鼠死亡率由80%降低到了0%。值得注意的是,NAMBs在血清中也能自组装,预示着良好的临床转化潜力。
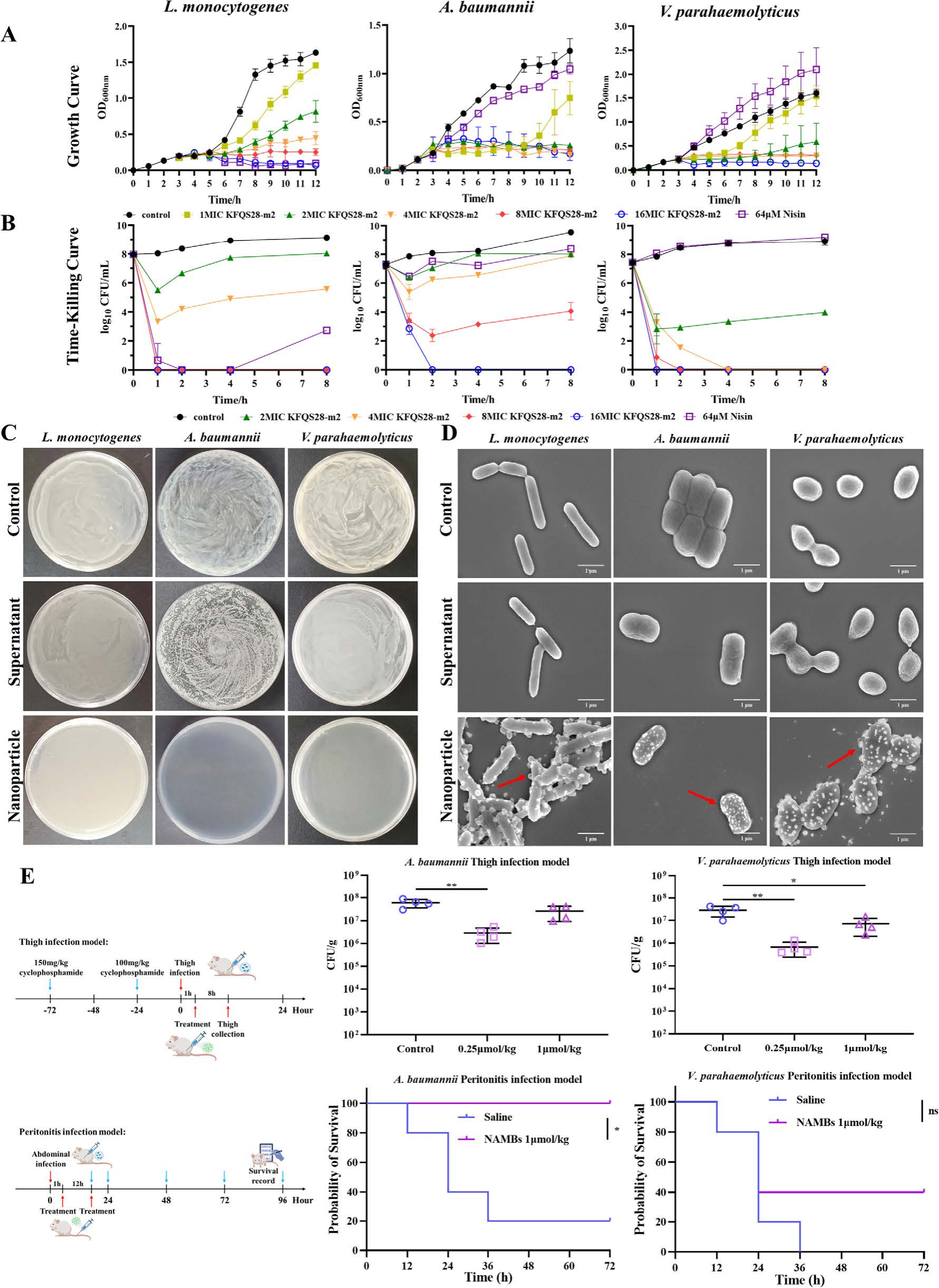
图5自组装抗菌细菌素纳米粒子的抗菌活性。
研究结果4:细菌素纳米颗粒具有多样化的作用机制
NAMBs主要通过靶向破坏细菌细胞被膜发挥作用,但对不同类型细菌呈现差异化调控。扫描电镜显示,纳米颗粒优先结合细菌表面:李斯特菌出现膜凹陷,鲍曼不动杆菌膜结构崩塌,副溶血弧菌甚至发生细胞裂解。透射电镜进一步捕捉到膜穿孔和内容物泄漏的瞬间——革兰氏阴性菌因脂质双层的脆弱性,几乎被“掏空”成空壳。共聚焦显微镜动态记录显示,FITC标记的NAMBs(绿色荧光)与尼罗红染色的细胞膜(红色荧光)高度共定位,证明其作用靶点为细胞被膜。膜通透性实验证实,NAMBs在8MIC下破坏效果甚至超过蜂毒肽(melittin),且内膜损伤比外膜更显著。
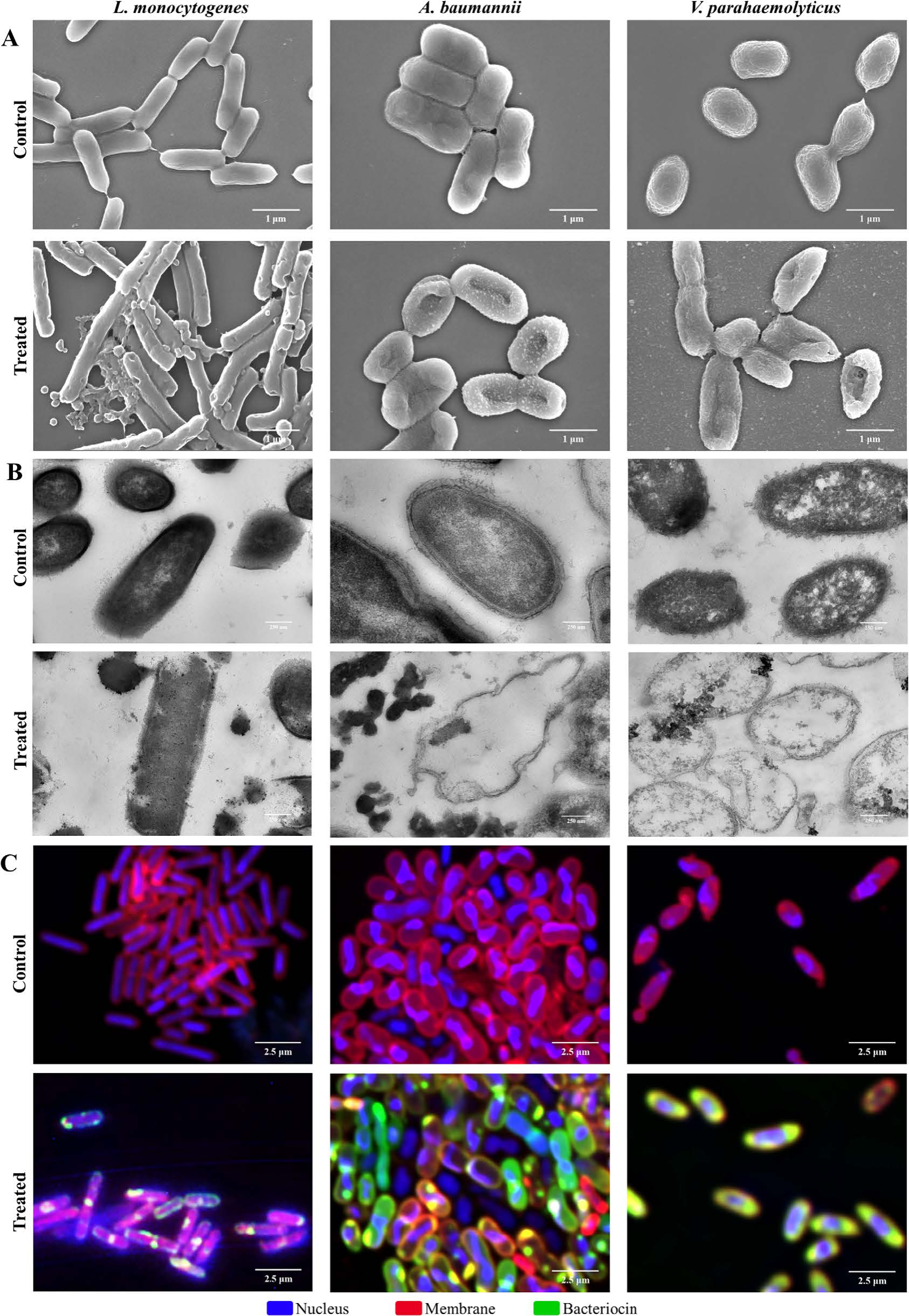
图6自组装细菌素纳米颗粒的抗菌机制。
基因表达谱揭示了更深层机制:在李斯特菌中,NAMBs强化肽聚糖层的同时削弱磷壁酸合成,导致碳水化合物代谢紊乱;在鲍曼不动杆菌中,脂肪酸合成关键酶(Acc、FabZ)被抑制,磷脂组成失衡,脂多糖完整性遭破坏。这种“破坏-重建”的动态博弈,最终拖垮细菌的生存系统。
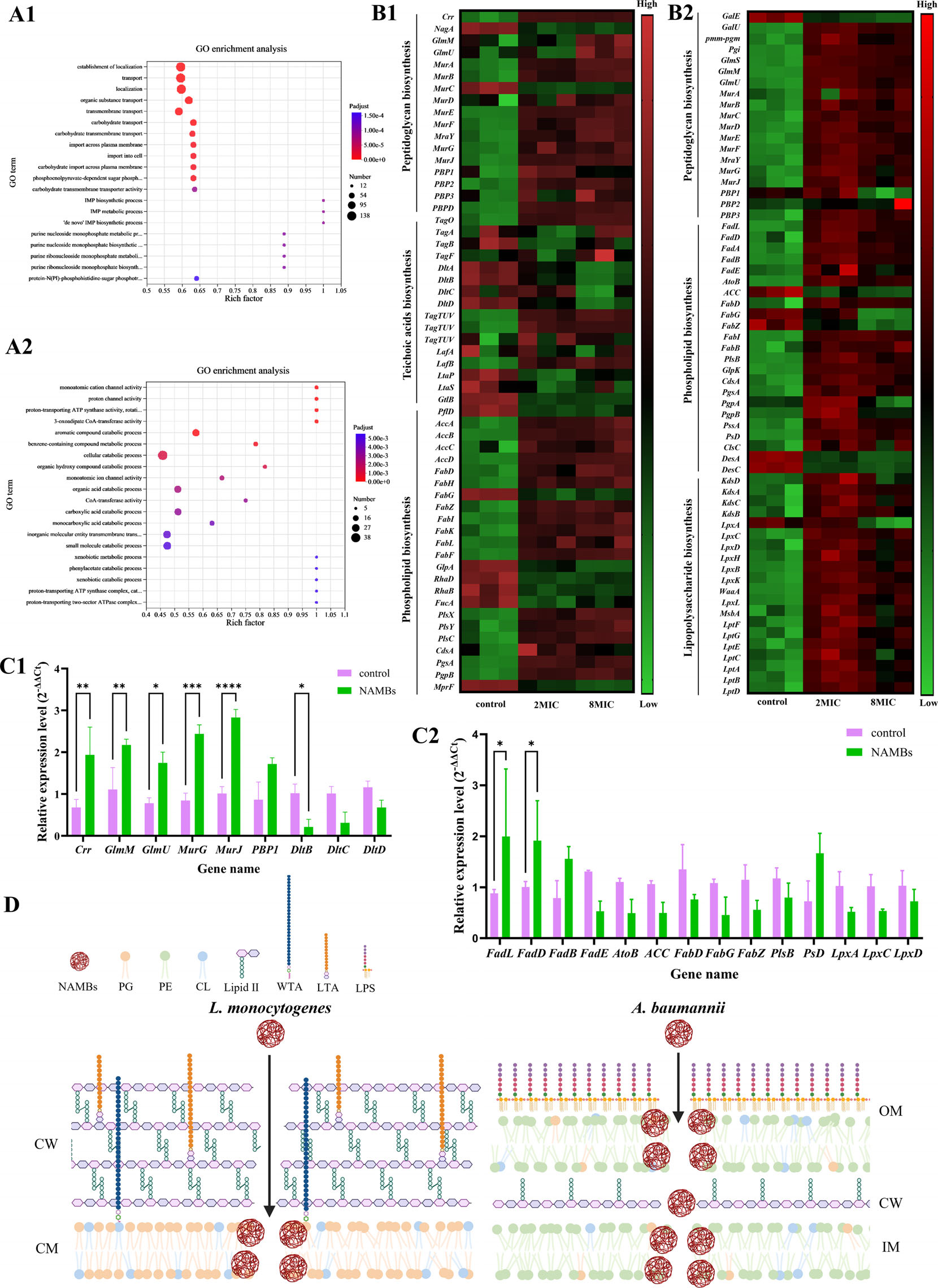
图7细菌对细菌素纳米颗粒处理响应的功能注释、基因表达及通路富集分析
这项研究不仅提供了一种新型抗菌武器,更开创了无载体自组装策略的先河。通过简单调控NaCl浓度、pH或溶剂极性,即可精确控制纳米颗粒的尺寸与形貌,这为规模化生产奠定基础。相比传统抗生素,NAMBs具有靶向性强、不易诱发耐药性、生物相容性高等优势,应用潜力巨大。
引用文献:
Lanhua Yi, Shengyang Li, Miaomiao Xie, Bozhou Chen, Kaichao Chen, Zhouxia Wang, Min Zeng, Qian Zhao, Jiyu Yang, Yang Tang, Wenxing Zhao, Ping Zeng, Xuecheng Li, Jiaqi Wang, Kaifang Zeng*,Yuyue Zhong*,Sheng Chen*.Novel Antimicrobial Nano Bacteriocin: Lactic Acid Bacteria-Derived, Self-Assembled, and Enhanced for Superior Antimicrobial Activity.Advanced Materials, 2026, 0: e11782.
https://doi.org/10.1002/adma.202511782
(易兰花 供稿 王晨 校稿 张宾佳 审稿)